탄소와 수소의 결합 각도, 정말 90도일까?
화학을 처음 배우거나 탄소의 결합을 그림으로 표현할 때, 탄소가 수소 4개와 결합을 이루는 형태를 상상해 보면 직각(90도)으로 배열되어 있다고 착각하기 쉽습니다.
이는 그림으로 표현할 때, 2차원 평면에서 탄소와 수소의 결합을 그리기 때문인데요,
실제로 탄소 원자는 3차원에서 결합을 이루기 때문에 각도가 109.5도가 됩니다.
그렇다면 왜 109.5도일까요?
단순히 "3차원 구조에서 가장 안정적이기 때문"이라는 설명으로는 부족합니다. 이 각도는 수학적으로 ‘탄소의 전자 배치와 결합 에너지를 최소화하려는 자연의 법칙’에서 비롯됩니다.
이제 본론에서 이 각도가 나오는 과정을 수학적으로 탐구해 보겠습니다.
탄소-수소 결합 각도가 109.5도가 되는 수학적 이유
정사면체 구조에서 각도 109.5도가 나오게 되는 과정을 이해하려면, 탄소를 중심으로 결합한 수소 원자들이 3차원 공간에서 ‘가장 멀리 떨어질 수 있는 배열’을 만든다고 가정합니다. 이를 다음과 같이 설명할 수 있습니다.
(1) 정사면체의 기본 정의
정사면체는 4개의 꼭짓점(수소 원자의 위치)과 하나의 중심점(탄소 원자)을 가지는 입체 구조입니다. 이 구조는 4개의 꼭짓점이 동일한 거리를 유지하면서 중심점에서 대칭적으로 배치됩니다.
정사면체의 중요한 특징은 그 대칭성입니다. 정사면체의 4개 꼭짓점은 원점에서 균등하게 배치되어야 하며, 서로 같은 거리를 유지합니다. 이 대칭성에 의해 정사면체의 꼭짓점들은 특수한 방식으로 정의됩니다
[정사면체 꼭짓점 좌표 유도 과정]
1) 균등 배치
정사면체는 3차원 공간에서 대칭적인 구조를 가지므로, 각 꼭짓점은 원점에서 균등하게 떨어져 있습니다. 각 점은 서로 일정한 각도를 이루며, 각 꼭짓점은 원점으로부터 동일한 거리 r만큼 떨어져야 합니다.
2) 공간 좌표 설정
정사면체의 각 꼭짓점은 원점에 대해 대칭적으로 배치됩니다. 이때, 각 점이 다른 3차원 축을 기준으로 대칭적으로 배치되도록 선택됩니다.
3) 특정 좌표 값 선택
정사면체의 4개의 꼭짓점은 x, y, z 좌표에 대해 +1과 -1을 결합하여 정의됩니다. 이때, 각 좌표 값은 정사면체의 대칭성을 유지하면서 서로 같은 거리를 이루는 방식으로 선택됩니다.
(2) 정사면체의 4개 꼭짓점 좌표
중심점을 원점(0,0,0)으로 놓고 수소 원자의 위치를 3차원 좌표계에서 다음과 같이 설정할 수 있습니다:
첫 번째 수소: (1,1,1)
두 번째 수소: (−1,−1,1)
세 번째 수소: (−1,1,−1)
네 번째 수소: (1,−1,−1)
이 네 점은 정사면체의 꼭짓점에 해당하며, 각 점이 원점으로부터 동일한 거리에 배치됩니다. 그리고 각 점이 서로 대칭적으로 배치됩니다.
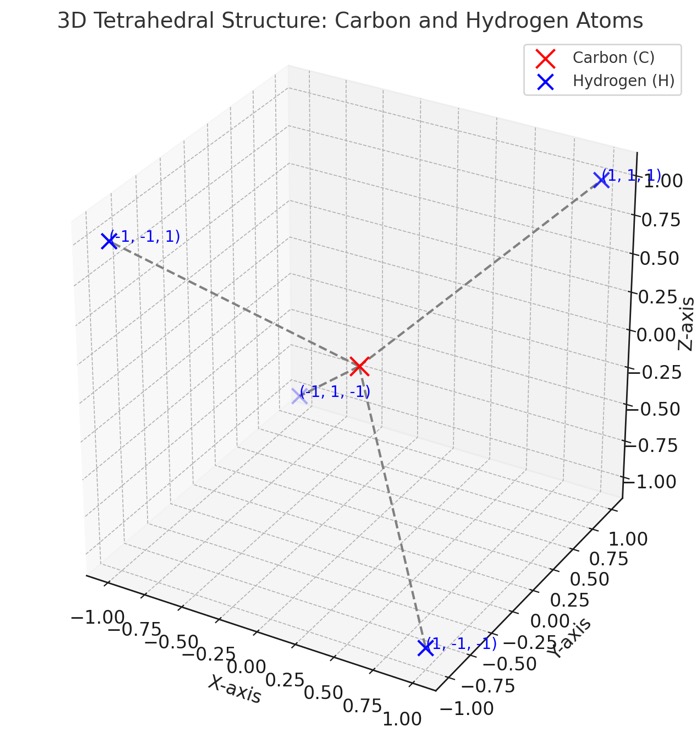
(3) 중심에서 각도를 계산하기 위한 벡터 분석
각도를 계산하기 위해 두 벡터 사이의 각도를 구합니다.
두 수소 원자의 위치를 나타내는 벡터를 각각
A=(1,1,1)와
B=(−1,−1,1)로 둡니다.
벡터 A와 B 사이의 각도 θ는 코사인 법칙으로 계산됩니다:
cosθ = A⋅B / ∣A∣∣B∣
-두 벡터의 내적 A⋅B:
A⋅B=(1)(-1) + (1)(-1) + (1)(1) = -1
-벡터의 크기 ∣A∣와 ∣B∣:
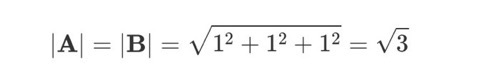
따라서 코사인 값은
cosθ = -1 / 3 입니다.
cosθ=−1/3인 각도 θ는 약 109.5도로 계산됩니다.
3. 결합 각도의 물리적 의미
109.5도라는 각도는 단순히 수학적 계산의 결과가 아닙니다. 이는 탄소 원자의 전자 구름이 서로 가장 멀리 떨어져 배치될 수 있는 상태를 나타냅니다. 이렇게 배열되면 전자 간의 반발력이 최소화되고, 결합 에너지가 안정적으로 유지됩니다.
결론
탄소가 수소 4개와 결합할 때 109.5도라는 각도가 나오는 이유는 3차원 공간에서 전자 구름 간의 반발을 최소화하고, 에너지를 안정화하기 위한 자연의 법칙에서 비롯됩니다. 이는 정사면체 구조라는 아름다운 대칭성과 수학적인 원리를 통해 설명할 수 있습니다.
처음에 90도로 오해할 수 있지만, 탄소 결합의 진정한 각도는 자연의 최적화를 반영한 109.5도입니다. 이 각도는 화학적 안정성과 수학적 원리를 동시에 만족시키는 완벽한 구조라 할 수 있습니다.
'과학' 카테고리의 다른 글
| 세포의 크기가 작은 이유, 표면적과 부피 관계 (0) | 2024.12.24 |
|---|---|
| GMO 식품 - 유전자 재조합 기술 (유전자 변형 방법) (0) | 2020.02.24 |
| 작용반작용 법칙 (축구 과학적 원리) (0) | 2020.02.23 |

